|
BAB 2
GAMBARAN UMUM PERUSAHAAN
2.1.
Sejarah Perusahaan
PT Dankos Laboratories
Tbk atau lebih dikenal dengan nama
Dankos didirikan
pada tanggal 25
Maret 1974 di Pulomas, Jakarta Timur, dan memulai kegiatan
operasinya di bidang obat-obatan pada tahun 1978 dengan lahan seluas 500 m²
. Setelah
beroperasi selama empat tahun di Pulomas,
Dankos
memindahkan
kegiatan
operasionalnya di Kawasan Industri Pulogadung dengan luas lahan 12.800 m² dan luas
bangunan 3.925 m².
Pada
tahun
1986,
Dankos
mendapatkan
lisensi
produk dari Fujisawa
(Jepang)
dan Daiichi (Jepang). Produk-produk yang dihasilkan oleh Dankos saat ini adalah :
a. Obat Bebas (OTC)
Cream
: Trimadan
Granule
: Fiber
Liquid
: Mixagrip Syrup Strawbery & Orange
Tablet
: Fatigon, Minigrip, Mixadin, Mixaflu, Mixanal, Mixagrip
b. Obat Resep (Ethical)
Cream
: Oxyzone
Injeksi
: Cefizox, Cefazol Foxim Hexer, ATP DK, Brainact
Kapsul
: Climadan, Fixef, Longcef, Neurotam, Forneuro
|
|
8
Liquid
: Profilas, Spiradan, Topcillin, Neciblok, Viaclav
Tablet
: Allohex, Danoflox, Emineton, Citaz, Fordesia
Ointment : Oviskin
c. Export (OTC)
Granule
: Fiber Exp
Liquid
: Dantusil Syrup Exp
Tablet
: Dancimin, Fatigon, Mixaflu, Minigrip, Mixadin, Mixanal
Sejalan
dengan
pertumbuhan
ekonomi
Indonesia,
maka
pada
tanggal
13
November
1989,
Dankos
melakukan
go
public
dengan
mencatatkan
sahamnya
pada
Bursa Efek Jakarta dan Surabaya. Pada tahun 1990 Dankos mulai melakukan export obat
bebas (OTC) ke sepuluh negara (Asia & Afrika). Pada tahun yang sama PT. Dankos
Laboratories memperoleh 100% saham PT. Bintang Toejoe.
Dankos memperoleh sertifikat GMP (Good Manufacturing Practice) pada tahun
1991. Dankos membangun gedung Penicilin dan gedung Cephalosporin pada tahun 1993
untuk perluasan dan peningkatan produksi. Pada tahun
yang sama Dankos
memperoleh
seluruh
asset
PT.
Hexpharm Jaya.
Pada
tahun
1995
Dankos
memperluas
pabriknya
menggunakan bangunan Ex Helios yang letaknya bersebelahan dengan luas lahan 5.898
m²
dan luas bangunan 3.868 m2
.
Dankos selalu berkomitmen
untuk meningkatkan
mutu
dan kualitas produk yang dihasilkan, hal ini dibuktikan dengan menjadi Industri Farmasi
Indonesia
yang pertama kali
memperoleh
sertifikat ISO 9001 pada tahun 1997,
perbaikan yang berkesinambungan, 5R (Ringkas, Rapi, Resik, Rawat, Rajin), DCC
(Dankos Customer Care) di seluruh bagian. Selain itu Dankos menjadi Industri Farmasi
Indosnesia yang mampu memproduksi obat soft capsule.
|
|
9
Pada bulan Juli 2004
Dankos
memperoleh sertifikat ISO 14001 mengenai
mutu
lingkungan dan pengolahan limbah cair. Kemudian pada bulan Septembeer 2004 Dankos
memperoleh
sertifikat
OHSAS
(sertifikat mengenai K3), untuk menjaga serta
meningkatkan keselamatan dan kesehatan lingkungan kerja.
2.2.
Profil Perseroan
PT. Dankos Laboratories Tbk merupakan perusahaan farmasi PMDN terkemuka
di
Indonesia,
dan
sebagai
perusahaan Go
Public sejak tahun
1989,
dimana
secara
konsisten
menerapkan
CPOB
dan
ISO
9001
dalam
memproduksi
obat-obatan
(Obat
resep dan Obat Bebas), serta memiliki pemasaran di dalam maupun luar negeri.
Perseroan beserta tiga buah anak perusahaan menghasilkan produk obat bebas
(OTC)
yang
memberikan
kontribusi
kepada
penjualan
sebesar
81%
dan
produk
obat
resep (ethical) yang memberikan kontribusi sebesar 16%. Disamping itu Perseroan juga
menerima
kontrak
produksi
dari perusahaan
farmasi
lainnya
yang
mana kontrak
produksi itu memberikan kontribusi sebesar 3%.
PT. Dankos Laboratories. Tbk memiliki 3 anak perusahaan, yakni:
PT.
Bintang
Toedjoe (99,99%), dimana
produk
yang
dihasilkan
antara
lain
Extra
Joss, Komix, OSK 16, Waisan
PT.
Hexpharm Jaya Labs
(99%), dimana produk
yang dihasilkan antara lain ATP
Kyowa, Spasminal, dan Benacol
PT. Saka Pharma Labs (80%), dimana produk yang dihasilkan antara lain Sakatonik
ABC, Sakatonik Liver, dan Mextril
|
|
10
Produk utama yang dihasilkan oleh PT Dankos Laboratories Tbk untuk golongan
OTC
(obat
bebas)
berupa
Mixagrip,
Fatigon, Mixadin, Minigrip.
Sedangkan
untuk
golongan ETH (obat resep) berupa Spiradan, Danalgin, Cefazol, dan Cefizox.
Lisensi yang dimiliki PT Dankos antara lain :
Fujisawa Pharmaceutical Co Ltd
Daiichi Pharmaceutical Co Ltd
Kyowa Pharmaceutical Co Ltd
Sato Pharmaceutical Co Ltd
Negara
tujuan
export PT.
Dankos
Laboratories.
Tbk antara
lain
Nigeria,
hongkong, Singapore, Myanmar, Malaysia, dan lainnya.
Selain meningkatkan kualitas produk, Perseroan juga selalu
menjaga
keselamatan kerja dan kesehatan lingkungan kerja. Hal ini tercermin dengan telah
diperolehnya sertifikat HACCP (Hazard
Analysis
Critical Control
Point) untuk PT.
Bintang Toedjoe dan sertifikat SMK3 (Sistem Kesehatan dan Keselamatan Kerja) untuk
PT. Bintang Toedjoe dan Perseroan sendiri.
|
|
11
2.3.
Non Beta Laktam dan Beta Laktam
PT.
Dankos
Laboratories.
Tbk
memiliki
3
gedung pabrik yang
terpisah
untuk
membuat obat-obat yang berbeda
A.
Pabrik untuk obat-obat golongan Non Beta Laktam
Pabrik ini memiliki gedung yang paling luas dan karyawan paling banyak
karena untuk membuat sebagian besar obat-obat yang dihasilkan oleh
perusahaan.
Bentuk sediaan yang dibuat di pabrik ini yaitu:
1. Tablet Inti (Plain Tablet)
2. Tablet Salut Selaput (Film Coated Tablet)
3. Tablet Salut Gula (Sugar Coated Tablet / Dragee)
4. Kapsul Cangkang Keras (Hard Capsule)
5. Kapsul Cangkang Lunak (Soft Capsule)
6. Sirup Kering (Dry Sirup)
7. Obat Cair untuk penggunaan luar / kulit (Topical Liquid)
8. Obat cair untuk penggunaan dalam / diminum (Oral Liquid)
9. Krim / Salep kulit (Topical Cream/ Ointment)
10. Salep mata (Eye Ointment / Ophthalmic Ointment)
11. Tetes mata (Eye Drops)
12. Tetes telinga
|
|
12
B.
Pabrik untuk obat-obat golongan Beta Laktam Penisilin
Pabrik
ini
dibangun
hanya khusus
untuk
membuat
obat-obat
golongan
Penisilin. Obat-obat golongan
penisilin ini
harus
dibuat terpisah sama sekali
dari obat-obat lain karena kalau tidak obat-obat lain dapat terkontaminasi oleh
penisilin.
Obat-obat
golongan
ini
sangat
berbahaya
bagi
orang-orang
tidak
peka atau alergi terhadap obat ini.
Bentuk sediaan yang dibuat di pabrik ini, yaitu:
1. Tablet inti (Plain Tablet)
2. Tablet salut selaput (Film Coated Tablet)
3. Kapsul keras (Hard capsule)
4. Sirup kering (Dry Syrup)
C.
Pabrik untuk obat-obat golongan Beta Laktam Sefalosporin
Pabrik ini dibangun khusus untuk membuat obat-obat golongan Beta Laktam
Sefalosporin. Obat ini juga dapat menimbulkan alergi, meski efeknya tidak
sedahsyat
Penisilin.
Pembuatan
obat
ini
harus
terpisah
dari
penisilin
karena
obat golongan ini terkadang diberikan untuk pasien yang tidak tahan terhadap
penisilin.
Untuk sediaan yang dibuat di pabrik ini yaitu:
1. Tablet inti (Plain Tablet)
2. Tablet Salut selaput (Film Coated Tablet)
3. Kapsul keras (Hard Capsule)
4. Sirup kering (Dry Syrup)
5. Injeksi serbuk (Powder Injection)
|
 13
2.4.
Visi dan Misi
VISI
PT Dankos Laboratories Tbk
Senantiasa menjadi perusahaan farmasi yang mempunyai komitmen kuat
untuk meningkatkan kesejahteraan masyarakat melalui penerapan ilmu
dan teknologi di tingkat nasional dan regional serta sebagai pemberi kerja
terbaik di Indonesia.
As an industrial company that has strong commitment in developing
quality and innova-tive health care products through application of
science and
technology, which are
marketed
nationally as
well
as
regionally with the main focus in customer satisfaction.
Gambar 2.1 Pernyataan Visi PT Dankos Laboratories. Tbk
MISI
PT Dankos Laboratories Tbk
Sebagai
sebuah
grup
perusahaan yang
senantiasa
melakukan
perbaikan
yang berkesinambungan untuk menghasilkan produk kesehatan yang
berkualitas melalui pengembangan produk yang inovatif, mudah diperoleh
dan
terjangkau
oleh
masyarakat
luas sehingga
ikut berperan
serta dalam
meningkatkan kesejahteraan masyarakat.
As a company that has business in industry which produces quality,
affordable,
and
easy
to
obtain
health
care
products,
as
well
as
helps
creating health and welfare of society.
Gambar 2.2 Pernyataan Misi PT Dankos Laboratories. Tbk
|
 14
MOTTO
PT Dankos Laboratories Tbk
“Mutu Untuk Kesehatan Dan Hidup Yang Lebih Baik”
Gambar 2.3 Pernyataan Motto PT Dankos Laboratories. Tbk
2.5.
Rencana Masa Depan
Walaupun industri farmasi tahun 2005 ini ditandai dengan semakin ketatnya
kompetisi yang disebabkan oleh masuknya beberapa pemain baru dan banyaknya produk
sejenis yang dikeluarkan oleh beberapa perusahaan farmasi, manajemen Perseroan tetap
berkeyakinan bahwa Perseroan akan tetap bertumbuh di atas pertumbuhan pasar farmasi
dengan menerapkan beberapa strategi.
Perseroan dalam jangka pendek tidak akan menfokuskan pada peluncuran produk
baru tetapi hanya akan menfokuskan pada pengembangan varian baru dari produk obat
bebas yang sudah ada di pasaran seperti menambah variasi ukuran kemasan dari merek
produk yang sudah ada. Strategi ini bertujuan untuk meningkatkan permintaan dan
produksi sehingga diharapkan utilitas pabrik dapat ditingkatkan. Dengan adanya variasi
ukuran kemasan
ini
diharapkan
konsumen dapat
mempunyai
alternatif pilihan
ukuran
kemasan sesuai dengan kebutuhan dan kondisi ekonominya. Dengan demikian pada
akhirnya penjualan dapat ditingkatkan dan demikian pula dengan pangsa pasar.
Perseroan di masa depan tetap akan menfokuskan untuk memproduksi obat
bebas namun Perseroan juga tidak akan mengabaikan produk obat resep.
Pengembangan usaha yang dilakukan oleh Perseroan mencakup peningkatan pemasaran
|
|
15
domestik
maupun
luar
negeri.
Untuk
meningkatkan pemasaran
luar
negeri, Perseroan
akan menjajaki untuk memasuki negara-negara baru seperti China dan Laos.
Dalam rangka
untuk
meningkatkan
efisiensi
dan
efektifitas
kerja,
Perseroan
senantiasa meningkatkan teknologi informasi seperti perbaikan jaringan komunikasi dari
pusat
ke
cabang,
perbaikan
sistem dan
prosedur
akuntansi,
pembuatan
program
komputerisasi untuk memonitor biaya promosi. Karena dengan adanya peningkatan
efisiensi dan efektifitas kerja ini pada akhirnya akan mempengaruhi kinerja Perseroan.
Perseroanpun
di
masa
mendatang
tetap memperhatikan hal-hal yang
berhubungan
dengan
peningkatan standard
pelayanan
baik
untuk
konsumen
internal
maupun eksternal, seperti pada tahun 2004 diterapkannya standard pelayanan yang baik
kepada
para
dokter,
adanya
petugas
khusus
untuk
melakukan
updating
website
Perseroan khususnya yang berhubungan dengan pemasaran sehingga para dokter
mendapatkan informasi terkini mengenai hal-hal yang berhubungan dengan produk obat
resep Perseroan.
2.6.
CPOB (Cara Pembuatan Obat yang Baik)
CPOB adalah singkatan dari Cara Pembuatan Obat yang Baik, yang dalam
bahasa Inggris disebut GMP (Good Manufacturing Practice).
Pedoman
CPOB
merupakan keputusan Menteri Kesehatan Republik Indonesia No.
43/Menkes/SK/11/1988 yang harus dilaksanakan oleh semua industri farmasi untuk
menjamin khasiat, keamanan dan mutu obat yang dihasilkan.
|
|
16
Mengapa obat harus bermutu? Obat harus bermutu karena bila digunakan dengan
tepat dapat meringankan dan menyembuhkan penyakit serta menyelamatkan jiwa
penderita.
10 Perintah GMP (Good Manufacturing Practice) :
1.
Pastikan bahwa anda memiliki instruksi tertulis yang benar sebelum mulai
melaksanakan tugas
2.
Patuhi
selalu
instruksi-instruksi
tersebut secara
persis,
tanpa
melewati
sesuatu
apapun
3.
Pastikan bahwa anda menggunakan bahan yang benar
4.
Pastikan bahwa anda menggunakan peralatan yang benar dan bersih
5.
Hindarkan kontaminasi dan kesimpang siuran dalam hal apapun
6.
Jagalah terhadap kesalahan penandaan
7.
Bekerjalah selalu teliti dan persis
8.
Jagalah segalanya bersih dan rapi
9.
Waspadalah terhadap kesalahan dan kekeliruan, dan perbuatan/ kebiasaan yang
buruk dan laporkan segera apabila hal itu terjadi
10. Buatlah catatan mengenai tugas yang telah dibuat dengan jelas dan teliti
|
|
17
2.7.
Manajemen Sumber Daya Manusia
2.7.1. Tenaga Kerja
PT Dankos Laboratories Tbk mempekerjakan dua tipe karyawan yaitu karyawan
tetap dan karyawan kontrak. Untuk karyawan lantai produksi, satpam, cleaning service
dan gardener PT Dankos Laboratories. Tbk melakukan outsourcing karyawan.
Untuk recruitment
karyawan kantor bagian HRD
menetapkan
standar
tertentu
beberapa proses pengujian yang harus dilalui pelamar. Jumlah tenaga kerja PT Dankos
Laboratories. Tbk hingga saat ini adalah sebagai berikut :
Karyawan tetap
= 1007
Karyawan Kontrak
=
27
Outsource
= 343
Hari kerja di PT Dankos Laboratories. Tbk adalah Senin – Sabtu dengan
pembagian waktu kerja sebagai berikut :
Karyawan kantor
Jam kerja
: 07.30 – 16.00 WIB
Karyawan Lantai produksi dan gudang
Shift I
:
07.30 – 16.00 WIB
Shift II
:
16.00 – 22.00 WIB
|
|
18
2.7.2. Sistem Penggajian
PT Dankos Laboratories. Tbk memberikan gaji pokok kepada karyawannya
sesuai dengan kebijakan yang dikeluarkan oleh pemerintah, dan jumlahnya meningkat
setiap tahunnya sesuai dengan kebijakan yang diterapkan oleh PT Dankos Laboratories
Tbk. Selain gaji pokok perusahaan juga memberikan THR (Tunjangan Hari Raya) dan
TAT (Tunjangan Akhir Tahun) sekali setiap tahunnya.
2.7.3
Kesejahteraan Tenaga Kerja
Untuk meningkatkan kesejahteraan para karyawannya, PT Dankos Laboratories
Tbk memberikan beberapa jaminan antara lain jaminan keselamatan kerja, jaminan hari
tua, jaminan kesehatan, poliklinik untuk pengobatan gratis.
Selain itu perusahaan juga melakukan beberapa kegiatan sosialisasi seperti
rekreasi, olahraga bersama, atau pengadaan lomba pada event tertentu.
|
 19
2.8.
Struktur Organisasi PT. Dankos Laboratories. Tbk
B
O
D
QMR
MR
EMR
OHSMR
CONIM
INTERNAL AUDIT
PLANT
PM
OTC
SM
OTC
ETH
BD
F
A
S
I
HRD&GA
PLANT
QA/QC &
R&D
PM ETH
SM ETH
FINANC
E
ACC
HRD
PERS
PROD.I
QA/QC
PPIC
MEDICA
L
M
S
I
T
LEGAL
GA
PROD.II
R
&
D
PCH
PROD.III
T&M
Gambar 2.4 Struktur Organisasi PT Dankos Laboratories. Tbk
2.9.
Sistem Kerja
Sistem Kerja merupakan suatu keseragaman dari kegiatan untuk tiap-tiap pekerja
oleh karena itu PT Dankos Laboratories Tbk sangat memperhatikan sistem kerja
terutama pada bagian produksi agar produktivitas dan efektivitas kerja mengalami
peningkatan.
|
|
20
2.9.1. Sistem
Kerja
dalam
Hubungannya
dengan
Keselamatan
dan
Kesehatan Tenaga Kerja
PT
Dankos
Laboratories
Tbk telah
merancang
sistem kerja
untuk
tenaga
kerja
lantai produksi dan gudang dengan mempertimbangkan kenyamanan
dan keselamatan
kerja
dengan
memperhatikan
beberapa
faktor
antara
lain
sikap
kerja,
dimensi
ruang
posisi kerja, kondisi lingkungan kerja, serta pengaturan fasilitas kerja.
Sistem kerja
yang
telah
dibuat oleh
PT Dankos
Laboratories
Tbk
untuk
lantai
produksi dan gudang adalah :
o
Sebelum memasuki lantai produksi karyawan harus menggunakan pakaian,
sarung tangan, dan shoe cover serta menggunakan masker yang telah disediakan.
o
Untuk
memasuki
lantai
produksi
karyawan
harus
memasuki
ruangan
sanitasi
agar tubuh bersih dari bakteri yang dapat mencemari lantai produksi.
o
Lantai produksi dibuat tertutup dari area luar dan diberi pendingin ruangan untuk
kebersihan dan kenyamanan kerja.
o
Mesin-mesin
di
sekat
dalam
ruangan
terpisah
dan
memiliki
ruang
gerak
yang
cukup
untuk
memudahkan pergerakan dan diberi bahan kedap suara agar tidak
terlalu bising
o
Untuk karyawan gudang
harus selalu menggunakan
helm dan sepatu boot
yang
khusus untuk karyawan gudang
o
Untuk
mengendarai
forklift
harus
dua
orang,
satu
mengemudi
dan
yang
lain
berada pada garpu.
|
|
21
2.10. Teknik dan Maintenance
Departemen
T&M
pada
PT.
Dankos
laboratories. Tbk bertugas menunjang
lancarnya
proses
produksi
dan
semua
operasi di
setiap
departemen
yang
ada
sesuai
dengan CPOB, ISO 9001, 5R, kepedulian terhadap pelanggan (Dankos Customer Care),
kesehatan dan keselamatan kerja.
Departemen T&M dikepalai oleh seorang T&M Manager, dan dibawahi 3 orang
supervisor, yakni :
•
Maintenance Supervisor
•
Utility Supervisor
•
Engineering Supervisor
2.11.
Proses Produksi
2.11.1.
Proses Produksi Tablet/Kaplet Inti
Langkah-langkah cara pembuatan tablet/kaplet inti adalah :
Penimbangan
Bahan
obat dari
gudang bahan baku
ditimbang sesuai
formula
dan
prosedur (bila perlu diayak terlebih dahulu).
Granulasi
Pada proses granulasi basah dilakukan pembautan bahan pengikat
serbuk, kemudian dicampur dengan bahan
obat sehingga
terbentuk
massa granul basah. Kemudian
diayak dan keringkan sehingga
mencapai kadar air tertentu dalam fluid bed dryer,
lalu diayak
lagi.
|
 22
Pada proses granulasi kering
bahan-bahan
obat
dislugging, lalu
diayak. Sedangkan pada proses pembuatan tablet/kaplet dengan
cetak langsung tidak ada proses granulasi/slugging.
Lubrikasi
Granul kering
yang terbentuk pada proses
granulasi basah/granulasi
kering, atau bahan obat untuk cetak langsung dimasukkan ke dalam
mixer dan dicampur dengan pelincir (lubricant).
Pencetakan
Hasil lubrikasi dicetak alam mesin cetak.
Penyetripan (Stripping)
Tablet/kaplet/kapsul dimasukkan ke dalam hopper mesin strip untuk
dilakukan penyetripan.
Pengemasan
Strip-strip
diberi
catch cover
dengan
mesin
dan
dikemas
dalam
individual box, lalu diberi kartu kontrol dan dimasukkan ke dalam
master box yang disegel. Hasil pengemasan dikirim ke gudang obat
jadi.
Penimbangan
Granulasi
Lubrikasi
Pencetakan
Penyetripan
Pengemasan
Gambar 2.5 Tahapan Proses Produksi Tablet/Kaplet Inti
|
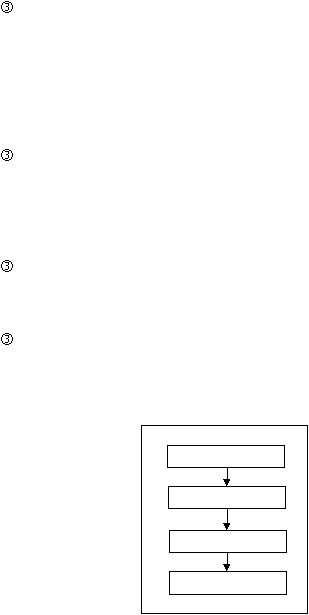 23
2.11.2.
Proses Produksi Tablet (Kaplet) Salut
Langkah-langkah cara pembuatan tablet (kaplet) salut adalah :
Penyalutan
Buat larutan penyalut sesuai dengan formula. Tablet/kaplet yang akan
disalut
dimasukkan
ke
dalam
mesin
film coating/coating
pan,
kemudian dilakukan penyalutan sesuai prosedur.
Polishing
Tablet/kaplet yang disalut gula dimasukkan ke dalam polishing drum
untuk selanjutnya dipolis dengan larutan polishing.
Penyetripan (Stripping)
Sama seperti pada penyetripan tablet/kaplet biasa.
Pengemasan
Sama seperti pada pengemasan tablet/kaplet.
Penyalutan
Polishing
Penyetripan
Pengemasan
Gambar 2.6 Tahapan Proses Produksi Tablet (Kaplet) Salut
|
|
24
2.11.3.
Proses Produksi Kapsul Keras
Langkah-langkah cara pembuatan Kapsul Keras adalah :
Penimbangan
Bahan-bahan
obat
ditimbang
sesuai formula
dan
prosedur
yang
ditetapkan.
Pencampuran
Bahan-bahan obat
dimasukkan ke
dalam mixer
kemudian
dicampur
sampai homogen.
Pengisian dan Penutupan
Masukkan
kapsul-kapsul
kosong
ke
dalam mesin
pengisi
kapsul.
Bahan obat yang sudah dicampur dimasukkan ke dalam hopper
mesin, kemudian dilakukan pengisian dan penutupan kapsul.
Penyetripan
Kapsul-kapsul
yang
telah
diisi dimasukkan
ke
dalam hopper
mesin
strip untuk penyetripan.
Pengemasan
Strip-strip
dikemas
dalam individual
box,
diberi
kartu
kontrol
lalu
dimasukkan ke dalam
master box dan disegel. Hasil pengemasan
dikirim ke gudang obat jadi.
|
 25
Penimbangan
Pencampuran
Pengisian &
Penutupan
Penyetripan
Pengemasan
Gambar 2.7 Tahapan Proses Produksi Kapsul Keras
2.11.4.
Proses Produksi Kapsul Lunak
Langkah-langkah cara pembuatan Kapsul Lunak adalah :
Penimbangan dan pencampuran bahan obat
Sama seperti pada produksi kapsul keras
Pelelehan bahan cangkang
Bahan cangkang dicampur dan selanjutnya dimasukkan dalam gelatin
melting tank untuk dimasak.
Pengisian dan kapsulasi
Masukkan campuran bahan obat ke dalam hopper mesin strip untuk
pengisian
ke dalam pita
gelatin
yang
telah
dibentuk
sesuai dengan
bentuk dan ukuran yang diinginkan.
Pengeringan
Kapsul-kapsul yang dihasilkan dikeringkan dalam suatu ruangan pada
pH dan suhu yang terkontrol.
Pencucian
Kapsul yang telah kering dicuci dengan larutan pencuci.
|
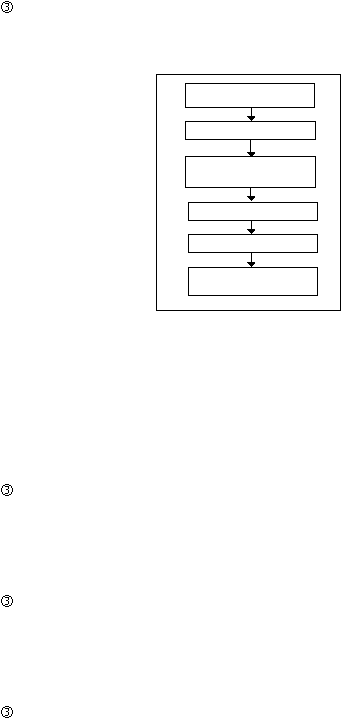 26
Penyetripan dan Pengemasan
Sama seperti pada produksi kapsul keras.
Penimbangan &
Pencampuran
Pelelehan
Pengisian
&
Kapsulasi
Pengeringan
Pencucian
Penyetripan
&
Pengemasan
Gambar 2.8 Tahapan Proses Produksi Kapsul Lunak
2.11.5.
Proses Produksi Sirup Kering
Langkah-langkah cara pembuatan Sirup Kering adalah :
Penimbangan
Bahan-bahan obat ditimbang sesuai formula dan prosedur yang
ditetapkan.
Pencampuran
Bahan-bahan obat
dimasukkan ke
dalam
mixer kemudian dicampur
sampai homogen.
Pengisian
Bahan obat dimasukkan ke dalam hopper mesin pengisi, lalu diisi ke
dalam botol.
|
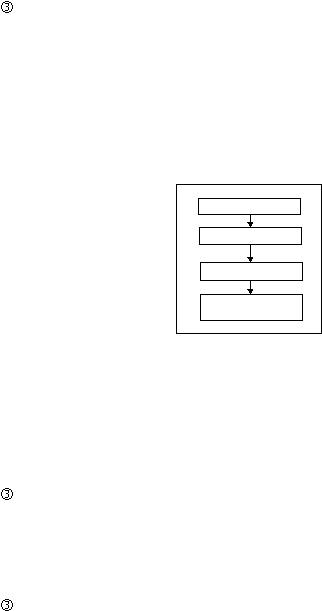 27
Pengemasan
Botol
yang telah berisi sirup kering dipasang
etiket dan dimasukkan
ke
dalam dus
kecil
dan
dilengkapi
dengan
brosur.
Kemudian
dimasukkan
ke
dalam individual
box. Hasil pengemasan
dikirim ke
gudang obat jadi.
Penimbangan
Pencampuran
Pengisian
Pengemasan
Gambar 2.9 Tahapan Proses Produksi Sirup Kering
2.11.6.
Proses Produksi Krim. Salep dan Jelly
Langkah-langkah cara pembuatan Krim, Salep dan Jelly adalah :
Penimbangan
Bahan-bahan
obat
ditimbang
sesuai formula
dan
prosedur
yang
ditetapkan.
Preparasi dan Pencampuran
Bahan obat tertentu dilarutkan terlebih dahulu dan simasukkan ke
dalam mixer.
Buat
fasa cair dan fasa
minyak kemudian dicampur di
dalam mixer sesuai dengan prosedur yang ditetapkan hingga
terbentuk massa salep.
|
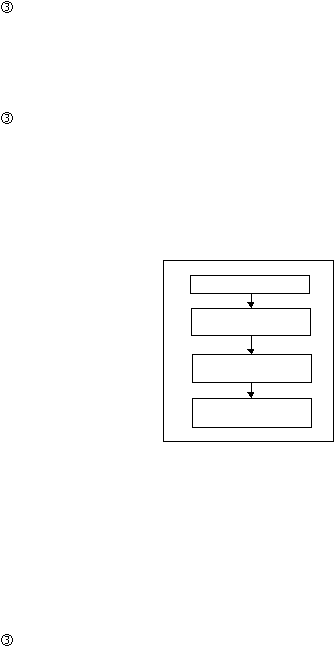 28
Pengisian dan Penutupan
Salep/krim/jelly diisi ke dalam tube yang telah bersih melalui
mesin
pengisi, lalu ditutup.
Pengemasan
Masukkan ke dalam dus kecil dan lengkapi dengan brosur. Masukkan
dus kecil ke dalam individual box, diberi kartu kontrol lalu
dimasukkan ke dalam master box, segel. Kirim ke gudang obat jadi.
Penimbangan
Preparasi &
Pencampuran
Pengisian
&
Penutupan
Pengemasan
Gambar 2.10 Tahapan Proses Produksi Krim, Salep dan Jelly
2.11.7.
Proses Produksi Cairan
Ada 2 jenis cairan
yang diproduksi yaitu cairan obat dalam dan
cairan
obat luar dengan tahapan produksi sebagai berikut :
Penimbangan
Bahan-bahan obat ditimbang sesuai formula dan prosedur yang
ditetapkan.
|
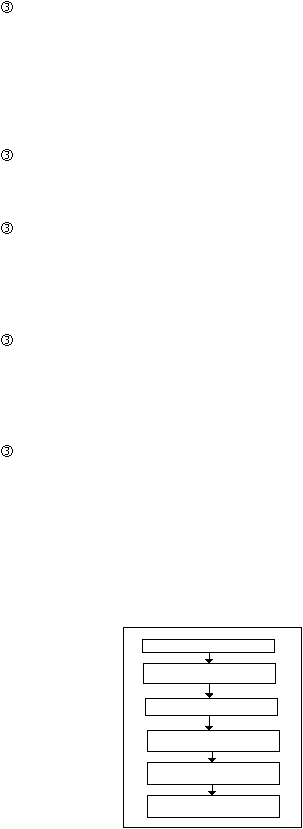 29
Preparasi dan Pencampuran
Bahan-bahan tertentu dilarutkan terlebih dahulu kemudian
dimasukkan
ke
dalam mixer
dan
dimasak
sesuai
prosedur
sampai
menjadi larutan sirup atau solution.
Penyaringan
Larutan yang dihasilkan disaring dengan saringan tertentu.
Pengisian dan Penutupan
Botol yang telah bersih dan kering diisi larutan dengan menggunakan
mesin pengisi, lalu ditutup.
Pemeriksaan Visual
Botol-botol yang telah berisi cairan diperiksa secara visual untuk
melihat ada tidaknya pecahan botol dan partikel asing.
Pengemasan
Botol yang telah berisi cairan dipasang etiket dan dimasukkan ke
dalam dus
kecil
dan
lengkapi
dengan
brosur.
Kemudian
dus
kecil
dimasukkan
ke
dalam individual
box,
diberi
kartu
kontrol
lalu
dimasukkan ke dalam master box, segel
Penimbangan
Preparasi &
Pencampuran
Penyaringan
Pengisian &
Penutupan
Pemeriksaan
Visual
Pengemasan
Gambar 2.11 Tahapan Proses Produksi Cairan
|
|
30
2.11.8.
Proses Produksi Tetes Mata & Injeksi Cairan
Langkah-langkah cara pembuatan Tetes Mata dan Injeksi Cairan adalah :
Sterilisasi
Sebelum proses produksi dimulai, terlebih dahulu dilakukan sterilisasi
ruangan, mesin, wadah, peralatan dan perlengkapannya.
Penimbangan
Bahan-bahan obat ditimbang sesuai formula dan prosedur yang
ditetapkan.
Preparasi dan Pencampuran
Bahan-bahan
tertentu
dilarutkan
terlebih
dahulu
kemudian
dimasukkan ke dalam mixer sesuai prosedur sampai terjadi larutan.
Penyaringan
Larutan yang dihasilkan disaring dengan saringan tertentu.
Pengisian
Botol/vial/ampul yang telah bersih, kering dan steril diisi larutan tetes
mata/injeksi dengan menggunakan mesin pengisi, lalu ditutup.
Pemeriksaan visual
Botol/vial/ampul
yang telah berisi cairan diperiksa secara visual
untuk melihat ada tidaknya pecahan botol/partikel asing.
Pengemasan
Botol
yang
telah
berisi
larutan
dipasang
etiket dan
dimasukkan
ke
dalam dus kecil dan dilengkapi dengan brosur. Kemudian dimasukkan
|
 31
ke dalam
individual box, diberi kartu kontrol dan dimasukkan ke
dalam master box.
Sterilisasi
Penimbangan
Preparasi &
Pencampuran
Penyaringan
Pengisian
Pemeriksaan
Visual
Pengemasan
Gambar 2.12 Tahapan Proses Produksi Tetes Mata dan Injeksi Cairan
2.11.9.
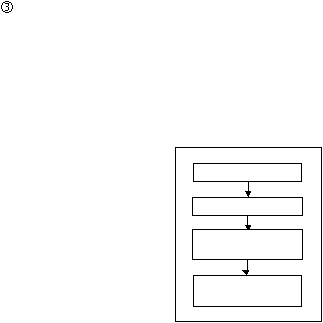
Proses Produksi Injeksi Serbuk
Langkah-langkah cara pembuatan Injeksi Serbuk adalah :
Sterilisasi
Sebelum proses produksi dimulai terlebih dahulu dilakukan sterilisasi
ruangan, mesin, wadah, peralatan dan perlengkapannya.
Pengisian
Vial yang telah bersih dan steril diisi serbuk steril dengan
menggunakan mesin pengisi, lalu ditutup.
Pemeriksaan Visual
Vial
yang
telah berisi
serbuk
diperiksa
secara
visual
untuk
melihat
ada/tidaknya pecahan botol/partikel asing.
|
 32
Pengemasan
Vial-vial
dimasukkan
ke
dalam dus
kecil
dan
dilengkapi
dengan
brosur. Kemudian dimasukkan ke dalam individual box, diberi kartu
kontrol dan dimasukkan ke dalam master box, segel.
Sterilisasi
Pengisian
Pemeriksaan
Visual
Pengemasan
Gambar 2.13 Tahapan Proses Produksi Injeksi Serbuk
2.12. Perencanaan dan Pengendalian Produksi (PPIC)
Bagian
Production
Planning
&
Inventory
Control (PPIC) bertugas membantu
jalannya perusahaan dengan melakukan control pada produksi dan penyimpanan bahan
baku.
Bagian PPIC terbagi dua sub-bagian penting yaitu:
a. Bagian Production Planning Control (PPC)
Bagian yang memiliki tanggung-jawab dalam hal perencanaan produksi.
b. Bagian Inventory Planning Control (IPC)
Bagian yang memiliki tanggung jawab dalam hal perencanaan penyimpanan
bahan baku.
|
|
33
2.12.1.
Production Planning Control (PPC)
PPC memiliki tugas secara umum, yakni menyusun perencanaan produksi
untuk tahunan serta bulanan, dan melakukan control
pada bagian produksi, apakah
produksi telah sesuai dengan target yang telah ditentukan. Dalam pembuatan
perencanaan produksi, bagian production planning control (PPC) menerima order dari :
1. Bagian Marketing
2. Toll in dari customer
3. Bagian R&D untuk trial produk baru
4. Bagian QC untuk rework / repack
Setelah
menerima
order
bagian
PPC
menganalisa
order
dengan stock
Finished Goods (FG). Jika stock FG cukup maka tidak ada rencana produksi, jika tidak
cukup
maka
bagian
PPC
akan
membuat
perhitungan RPP
(Rolling
Production
Plan).
Jika perhitungan RPP disetujui maka bagian PPC bersama dengan bagian produksi
membuat jadwal produksi mingguan, jika tidak maka bagian PPC melakukan
perhitungan ulang RPP.
2.12.2.
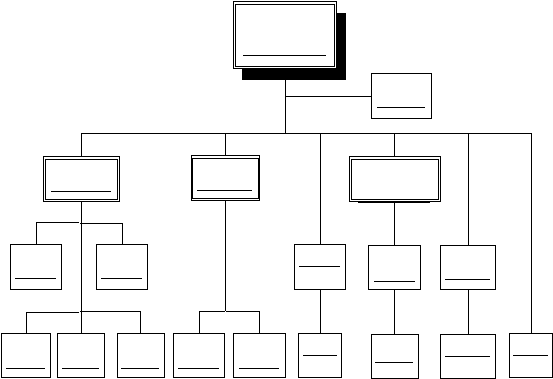
Inventory Planning Control (IPC)
Bagian
inventory
planning
control (IPC)
memiliki
tugas
umum,
yakni
melakukan perencanaan penyimpanan bahan baku, bertanggung jawab untuk
merencanakan bahan-bahan apa saja yang harus dibeli.
Dalam membuat rencana pembelian
bahan
baku
maka
bagian
IPC
melakukan analisa terhadap RPP yang dibuat oleh bagian PPC dengan stock Raw
|
 34
Material
(RM)
dan
Packaging Material
(PM)
yang
ada
digudang
dan
membandingkannya dengan Master Formula (MF) composition untuk membuat
Register Rolling Planning (RRP).
Setelah RRP dibuat maka bagian IPC akan membuat Material
Requirement Planning (MRP). Setelah MRP dibuat bagian IPC dapat melakukan
perencanaan pembelian RM dan PM.
2.13. Research and Development (R&D)
2.13.1. Struktur Organisasi Departemen R&D
Departemen R&D memiliki struktur organisasi sebagai berikut:
R&D
MANAGER
Administration
Staff
FORMULATION
MANAGER II
FORMULATION
MANAGER
I
STANDARDIZATION
ASS. MANAGER
Formulation
Supervisor
Formulation
Supervisor
Design
Supervisor
Standardizatin
Supervisor
Registration
Supervisor
Formulation
Staff II-A
Formulation
section head
Formulation
Staff II-B
Formulation
Staff I-A
Formulation
Staff I-B
Design
Staff
ANALIS
Regustration
staff
Library
Staff
Gambar 2.14 Struktur Organisasi Departemen R&D
|
|
35
2.13.2.
Tugas dan Kegiatan
Tugas umum dari bagian R&D adalah sebagai berikut:
Membuat formula obat baru
Melakukan
penelitian
terhadap
formula
obat
lama
(untuk
meningkatkan mutu dan reduksi biaya)
Melakukan registrasi formulasi baru / ulang ke badan POM
Bekerja sama dengan bagian QC dalam menentukan standarisasi
bahan baku kemasan dan obat jadi
Membuat desain art work untuk kemasan suatu produk baru
Mengelola perpustakaan
2.13.2.1.
Sub Bagian Desain
Sub bagian administrasi desain mengubah ide/usulan tentang bentuk dan
kemasan dari bagian pemasaran. Bagian Registrasi akan memeriksa desain yang telah
sesuai dan disesuaikan dengan persetujuan yang telah diberikan oleh Badan POM.
Apabila sesuai, rancangan kemasan akan dikirim ke bagian pemasaran,
scientific, produksi dan QC. Apabila semua kepala bagian telah menyetujui kemudian
diajukan
kepada
Direktur
untuk
mendapat
persetujuan
dan
akhirnya kepada bagian
pembelian untuk memesan sesuai dengan permintaan bagian PPIC.
|
|
36
2.13.2.2.
Sub Bagian Formulasi
R&D melakukan penelitian untuk mendapatkan formula obat baru
berdasarkan ide yang diajukan oleh bagian pemasaran. Bagian pemasaran memberikan
ide-ide atau
usulan untuk
membuat suatu produk baru yang dirasakan akan dapat laku
dipasaran.
Sub bagian formulasi dibagi menjadi Sub-bagian Formulasi-1 dan Sub-
bagian
Formulasi-2.
Sub-bagian
Formulasi-1
adalah
bagian
formulasi
non
solid, yaitu
untuk produk-produk
seperti
liquid dan cream. Sub-bagian Formulasi-2
adalah
bagian
formulasi solid, yaitu untuk produk-produk keras seperti tablet dan kaplet.
Tahap-tahap penyusunan suatu formula sediaan adalah sebagai berikut:
Tahap formulasi
R&D meneliti sifat fisik dan kimia bahan baku serta melakukan penelitian
terhadap produk sejenis.
Tahap formulasi dalam skala laboratorium
R&D mencoba menyusun beberapa formula sediaan dengan berbagai komposisi
maupun jenis bahan baku.
Tahap pengujian stabilitas
Formula-formula yang telah disusun R&D akan dicoba dan diteliti lebih lanjut
melalui tes stabilitas fisik (melihat perubahan bau, warna, waktu hancur selama
penyimpanan) dan tes stabilitas kimia (melihat kadar obat selama penyimpanan)
untuk dapat menemukan formula yang memenuhi persyaratan. Apabila hasil tes
baik, maka akan dilanjutkan tahap trial produksi.
|
 37
Tahap formulasi trial produksi
R&D melakuakn trial produksi bersama-sama dengan bagian produksi dan QC.
Trial produksi ini minimum dilakukan 3 kali dan tidak boleh gagal.
Master formula
Setelah diperoleh hasil trial produksi, maka R&D bekerja sama dengan bagian
QC
membuat
master
formula
yang
mencangkup
nama
produk,
komposisi
formula untuk tiap batch, daftar spesifikasi bahan pengemas yang digunakan,
prosedur pengolahan dan pengemasan,
daftar
peralatan
yang
digunakan,
pengawasan
In Process Control
yang harus dilakukan selama produksi, dan
tindakan-tindakan yang harus dilakukan apabila timbul masalah.
2.13.2.3.
Sub Bagian Register
Pada waktu bersamaan dengan trial produksi, sub bagian registrasi
melakukan pendaftaran produk baru ke POM.
2.13.2.4.
Sub Bagian Standarisasi
Tugas utama bagian standarisasi adalah:
Mengembangkan metode-metode analisa dan mutu produk
Menentukan standar mutu bahan sesuai dengan ketentuan farmasi dan
standard intern
Membuat
kontrol data
sebagai standar
bagi
R&D
sub-bagian
rutin
dalam melaksanakan metode analisa
|
 38
Menentukan
formula
baru
yang
dihasilkan
bagian
R&D dan apabila
terjadi ketidaksesuaian, maka R&D harus mengformulasikan kembali
Melakukan
pemeriksaan
dari
kontoh
cetakan
kemasan
baru,
untuk
mengetahui kesesuaian hasil cetakan dengan desain yang telah
disetujui
2.13.3.
Alat-alat Laboratorium
Departemen R&D dalam kegiatan
sehari-hari
memerlukan
peralatan-
peralatan yang digunakan untuk menunjang kegiatan penelitian dan pengembangan dari
obat-obat baik yang sudah ada maupun yang sedang dalam penelitian untuk diproduksi.
Berdasarkan hasil pengamatan
dari penulis selama pelaksanaan
periode
kerja praktek, peralatan-peralatan yang tersedia dalam departemen R&D antara lain:
Hardness Tester Schleuniger Type 6 D
Digunakan untuk mengukur kekerasan, juga dapat mengukur diameter dan
ketebalan sampel
Friability Tester Merk Erweka Type :TAR-10
Untuk mengukur besar kerapuhan dan pemerian dari sampel (tablet/kaplet)
Disintegration time tester Type ZT3 – Merk Erweka
Untuk menghitung waktu hancur tablet, maksimal 15 menit
Mesin cetak tablet
Untuk mencetak tablet
Vaccum Cleaner “Rowenta”
Hair Dryer
|
|
39
Refrigerator “National”
Timbangan Merk Mettler seri pe-model 160
Kapasitas maksimal 160 gram, ketelitian alat 0,001 g (1 mg)
Timbangan Sartorius Type 1264 MP
Kapasitas maksimal 2000 gram, ketelitian alat 0,01 g (10 mg)
Timbangan Analitik Merk AND seri GR 202
Untuk menimbang serbuk padat dengan kapasitas 210 gram, ketelitian alat
0,0001 g (0,1 mg)
HPLC Gradient Class VP
Untuk analisa kadar obat
HPLC Isokratik Class VP
Untuk analisa kadar obat
Inkubator merk Memmert seri UL – Model 50
Untuk pembiakan bakteri / jamur
Oven merk Memmert Seri D 06062 UM/ULM 600
Untuk menguji stabilitas kadar obat
Climate Chamber Hot Pack
Untuk uji stabilitas kadar obat -> waktu kadaluwarsa
Spektrofotometri
Untuk mengukur kadar serapan suatu bahan
Moisture Analyzer
Mesin untuk pengeringan
Erweka AR 400
PH Meter Merk Metrohm
|
|
40
String Hot Plate
Untuk memanaskan zat/larutan (suhu 150 C – 540 C) dan mengaduknya
Mixer seri T-Model 45
Untuk mencampur bahan / larutan homogenasi dan dispersi
Super mixer with Granulator
Rotavapor
Osmonat 030
Untuk menguji / mengukur isotomis larutan (obat tetes mata)
Sun test CPS +
Untuk menguji kestabilan produk terhadap pengaruh cahaya
Viscometer Brookfield LVTDV-11
Ultrasonic Bath
2.14. Tata Letak Pabrik
PT Dankos Laboratories Tbk terletak di Kawasan Industri Pulo Gadung dengan
luas tanah sebesar 18.698 M² dan luas bangunan sebesar 7.793 M².
Tata letak pabrik pada PT Dankos Laboratories Tbk terdiri atas :
1. Lantai Produksi
Untuk lantai produksi PT Dankos Laboratories Tbk Memiliki tiga jenis lantai
produksi yaitu:
a. Non Beta Laktam
Lantai produksi ini terletak di bawah Kantor utama dan merupakan lantai
produksi yang paling besar dengan jumlah karyawan produksi terbanyak.
|
|
41
b. Penicillin
Lantai produksi ini berada di belakang kantor utama dan dikhususkan
untuk memproduksi obat-obatan golongan penicillin.
c. Cephalosporin
Lantai produksi ini berada di belakanng lantai produksi penicillin. Sama
halnya dengan lantai produksi penicillin, produksi obat golongan
cephalosporin dilakukan secara terpisah agar tidak mencemari /
mengotori produksi obat yang lain.
2. Ruang Kantor
Ruang kantor pada PT Dankos Laboratories Tbk terbagi menjadi dua yaitu:
a. Ruang kantor Utama
Terletak di lantai dua atau berada di atas lantai produksi non beta laktam.
Pada ruang ini terdapat ruang direktur dan ruang departemen seperti
departemen PPIC, R&D, marketing, financial, HRD, dan pembelian.
b. Ruang kantor Pemasaran
Ruang ini berada diseberang kanan bangunan utama PT dankos
Laboratories
Tbk, Ruang ini berdiri sendiri karena Departemen
pemasaran banyak berhubungan dengan pihak Eksternal perusahaan.
|
|
42
3. Ruang Storage dan Warehouse
Ruang storage bersebelahan dengan
lantai produksi non beta
laktam,
hal ini
dimaksudkan untuk memudahkan pengiriman bahan RM/PM ke lantai
produksi
non
bera
laktam yang paling
banyak
memproduksi
obat-obat
PT.
Dankos Laboratories Tbk.
Ruang storage terbagi menjadi beberapa ruangan yaitu:
a.
Ruang Penimbangan
b.
Ruang pencucian botol
c.
Ruang penyimpanan bahan beracun
d.
Ruang penyimpanan bahan mudah terbakar
e.
Ruang penyimpanan bahan kemas
f.
Ruang penyimpanan utama
Ruang Warehouse bersebelahan dengan ruang kantor pemasaran. Ruang
warehouse dibagi menjadi tiga yaitu :
a.
Ruang penyimpanan utama
b.
Ruang refrigerator
c.
Ruang peyimpanan obat cair
4. Pengolahan Limbah
Areal
pengolahan
limbah
terletak
di bagian
belakang
bangunan
utama
PT.
Dankos
Laboratories
Tbk.
Areal
ini
dimaksudkan
untuk
mengolah
limbah
dari hasil produksi agar limbah tersebut tidak berbahaya bagi lingkungan
|
|
43
5. Fasilitas Pabrik
Fasilitas pabrik seperti
kantin,
musholla, parkir,
taman,
keamanan tersebar
secara merata di seluruh area pabrik.
|